Электролиз Алюминия
Алюминий краткое описание
Алюминий – химический элемент 3 группы с атомным номером 13 и атомной массой 26,98154 моль. Металлический алюминий — это металл с низкой плотностью (в твердом состоянии = 2,7 г/см3, что примерно в 3 раза меньше плотности железа) и матово-серебристым цветом. На воздухе алюминий моментальной покрывается тонкой и очень прочной плёнкой Al2O3, которая защищает алюминий от дальнейшего окисления. Обладает следующими полезными свойствами: легкость, коррозионная стойкость, свариваемость, высокая электропроводность и не токсичен. За счет этих свойств, алюминий является одним из самых востребованных металлов в современной промышленности.
Применение алюминия
Алюминий нашел применение во многих областях, таких как: пищевая промышленность (фольга и другая упаковка для продуктов питания и напитков), ракетостроение, приборостроение, транспортная промышленность, авиастроение, судостроение, производство посуды, мебели и т.д.

Алюминий применяется не в чистом виде, а с добавлением других металлов для улучшения свойств алюминиевого сплава. Для улучшения прочностных характеристик сплава добавляют медь, кремний, магний, цинк и марганец. Так, например, дюраль или дюралюминий является материалом, используемым в авиационном и транспортном машиностроении. Силумин – сплав алюминия с кремнием применяют для изготовления деталей сложной конфигурации в том же автомобиле и авиастроении. Магналии – сплавы получаемые добавлением в алюминий магния, который в свою очередь повышает коррозионную стойкость, пластичность и свариваемость. Из этого сплава изготавливают проволоку, заклепки, листы и фасонные отливки.
История развития алюминиевой промышленности
Название этого легкого металла произошло от латинского слова «Alumen», означающего «квасцы».
В 1825-м году ученый-физик из Дании Ханс Эрстэд был первым, кто впервые получил алюминий. Он восстановил хлорид этого металла амальгамой калия.
Этот способ усовершенствовал Фридрих Вёлер, используя для восстановления алюминия металлический калий, а также он описал химические свойства алюминия.
Впервые по полупромышленному способу производства алюминия с использованием натрия получил металл в 1854 г. Сен-Кльер Девиль, применяя натрий вместо менее безопасного калия. На следующий год Сен-Кльер Девиль на выставке в Париже в 1855 г. демонстрировал целый алюминиевый слиток, а уже в 1856 г. получил алюминий электролизом расплава хлорида алюминия-натрия.
Вплоть до создания широкомасштабного промышленного электролитического метода получения алюминия из глинозема (Al2O3), этот металл оценивался дороже золота.
Алюминий в России, прежде назывался «серебро из глины» или «глиний», потому что основной составляющей глины как раз и является глинозем.

Технологию получения металлов с помощью электролиза расплавленных солей, содержащего Al2O3, разработали не зависимо друг от друга в 1886 году американец Чарльз Холл и француз Поль Эру.
Способ получение первичного алюминия (метод Эру-Холла)
В настоящее время алюминий в промышленности получают в основном методом электролиза расплавленных солей (метод Эру-Холла) в аппарате, который называется – электролизер или электролизная ванна. Основным сырьем для получения алюминия является глинозем (Al2O3), который получают методом Байера из алюминийсодержащих руд (нефелины, бокситы, алуниты, каолины)
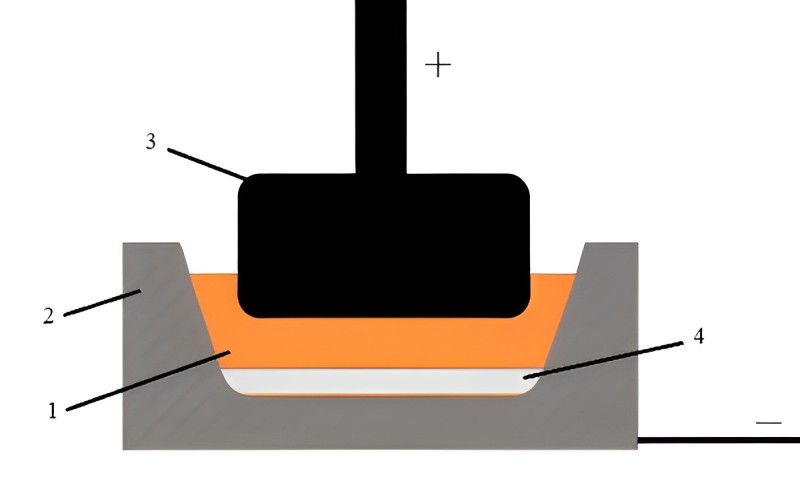
Схема электролизера
Электролиз ведут при температуре 960 ℃. В расплавленный криолитовый (Na3AlF6) электролит (1), который также служит проводником тока от катода (-)(2) к аноду (+)(3), загружается глинозем (Al2O3), где растворяется, образуя ионы. В общем виде реакция растворения глинозема выглядит так:
2Al2O3 → 4Al3+ + 3O2-(1)
Далее под действием магнитного поля, движения электролита и диффузии (перемещения ионов в область низких концентраций) ионы Al3+ перемещаются к отрицательно заряженному электроду (2), получают на нем 3 электрона и выделяются на катоде, выполненном из углеродного материала и служащим емкостью для расплавленного электролита, алюминия и подводом электрического тока к системе.
Al3+ + 3е- = Al0(2)
При температуре электролиза алюминий (4) находится в жидком состоянии и собирается в огромную каплю на дне (подине) электролизера. Жидкий алюминий позже выкачивается в вакуум ковш из ванны и отправляется в литейное отделение завода.
На графитовом аноде погруженном в электролит. Происходит следующая реакция:
2О2- - 4e- + С = СxОx(3)
Два иона кислорода под действием тех же сил, что и на Al3+, движутся, только уже к положительно заряженному электроду – аноду и отдают 4 электрона, при этом образуется молекула кислорода, которая при высоких температурах взаимодействует с материалом анода, образуя угарный (CO) и углекислый газ (CO2). Отходящие газы улавливаются секцией газосборного колокола и отправляются на газоочистку.
Таким образом полная реакция электролиза в общем виде выглядит так:
Al2O3(раств.) + 3 С (т) = 4 Al(ж) + 3 СО2(г)(4)
Основные параметры электролиза алюминия
Удельный расход электроэнергии
Все электрохимические процессы по своей природе являются энергоёмкими, так как для проведения реакций, которые в обычных условиях невозможны, необходимо обеспечить подвод энергии. Так как электрическая энергия передаётся в готовой форме, её стоимость становится доминирующим фактором. Её вклад в производственные затраты должен быть минимальным. Сравнение электролитического производства алюминия с другими электрохимическими процессами не в пользу первого. Поэтому исторически сложилось так, что новые алюминиевые заводы всегда размещались рядом с регионами, обладающими дешёвыми источниками электроэнергии. Доля электроэнергии в себестоимости металла составляет 15-30 %.
Удельный расход электроэнергии можно рассчитать по уравнению:
W = U / (kel ∙ η).(5)
где U - напряжение, kel - электрохимический эквивалент, η - выход по току.
На текущий момент удельный расход электроэнергии составляет 13 – 15 кВт∙ч / кг Al.
Это выражение показывает, что расход энергии можно снизить либо уменьшением напряжения на электролизёре, либо увеличением выхода по току.
Выход по току
Выход по току является важнейшим технико-экономическим показателем. Он показывает, насколько эффективно используется ток, и является одной из двух величин, определяющих величину удельного расхода электроэнергии. Причём наиболее эффективно уменьшать расход электроэнергии лучше всего именно путём увеличения выхода по току. Определение понятия «выход по току» очень ясно и недвусмысленно. Величина выхода по току определяется как:
η = (mп / mт) ∙ 100 %,(6)
где mп – масса выделившегося на катоде металла, определяемая взвешиванием; mт – масса металла, которая должна быть выделена. Она рассчитается по закону Фарадея:
mт = kel ∙ Q,(7)
где kel – электрохимический эквивалент, который представляет собой количество вещества, выделившегося при прохождении единицы количества электричества и рассчитывается следующим образом: kel = M / z∙F, где z – количество электронов, принимающих участие в электродной реакции; F – число Фарадея, постоянная величина, равная 96487 Кл (1 Кл = 1 А∙с) или 26,8 А∙ч. Электрохимический эквивалент алюминия равен 0,335575452 г/(А∙ч) или приблизительно 0,336 г/(А∙ч); Q – количество электричества, которое определяется как Q = I ∙ τ, [Кл], [А∙ч], I – ток; τ – время.
Отсюда видно, что увеличение производительности можно достичь двумя путями:
- увеличением силы тока;
- увеличением выхода по току.
Но изменение тока серии приводит к изменению энергетического баланса. С более же высоким выходом по току можно спокойно достичь максимальной производительности. Теоретически для производства 1 кг алюминия необходимо количество электричества, равное 2,98 кА∙ч.
Напряжение на ванне
Для того чтобы получить алюминий из глинозема, растворенного в расплавленном криолите и при этом поддержать необходимую температуру расплава над системой «алюминиевый электролизер», нужно совершить электрическую работу, в результате которой происходит изменение энтальпии (состояния веществ, участвующих в процессе) и передача тепла во внешнюю среду.
Определения:
Электрическая работа W - работа по перемещению заряда q в электрическом поле с напряжением U:
W = q ∙ U = I ∙ τ ∙ U.(8)
Энтальпия H – определяется уравнением:
Н = U + PV.(9)
Уравнение энергетического баланса ванны может быть записано как:
W = I ∙ τ ∙ U = Σni ∙ ΔHi + Q,(10)
где W – электрическая работа, совершаемая над электролизером за время τ; I – сила тока; n – число реагирующих молей веществ, Q – тепло, передаваемое в окружающую среду, Р – давление, V – объем.
Приложенная электрическая работа, и, как следствие, напряжение U, обусловлена материальным балансом и конструкцией электролизера. Следовательно, все действия, направленные на снижение напряжения, должны сопровождаться изменением конструкции (улучшение теплоизоляции) либо изменением технологических параметров (оптимизация состава электролита, уменьшение плотности тока). Для разных типов ванн и технологических приемов напряжение колеблется от 3.7 до 4.8 В. Ширина этого коридора зависит не только от конструкции ванны, но и от того какие границы используются для определения баланса напряжений.
Среднее напряжение включает следующие составляющие:
1. Напряжение разложения E° ~ 1.2 В.
2. Анодное перенапряжение, включающее:
- поверхностное анодное перенапряжение (перенапряжение реакции) ηaп ~ 0.4 – 0.6 В;
- анодное концентрационное перенапряжение ηaк ~ 0.004 – 0.006 В.
3. Катодное концентрационное перенапряжение ηc ~ 0.07 – 0.1 В.
Сумму этих четырех составляющих называют ЭДС поляризации или обратной ЭДС – Еэдс.
4. Падение напряжение в электролите: - связанное с его омическим сопротивлением, (I∙Rэл ) ~ 1.3 – 2.0 В;
-так называемое, “пузырьковое перенапряжение”, связанное с сопротивлением слоя пузырей под анодным массивом, (I∙Rпуз ) ~ 0.15 – 0.2 В.
5. Падение напряжение в анодном узле (I∙Ra ) ~ 0.2 – 0.3 В для Обожженных Анодов и ~ 0.4 - 0.6 В для анодов Содерберга.
6. Падение напряжение в катоде (I∙Rк) ~ 0.25 – 0.6 В.
7. Потери напряжение в ошиновке ванны (I∙Rош ) до ~ 0.3 В.
8. Падение напряжения в общесерийной ошиновке: в сумме до ~ 0,3 В
9. Дополнительное напряжение, связанное с АЭ ΔUAЭ до ~ 0.1 В.
Таким образом, суммарное уравнение, описывающее баланс напряжений на ванне, может быть записано в следующем виде:
U = Еэдс + η + ΔUэл + ΔUа + ΔUк + ΔUош + ΔUс + ΔUаэ. (11)
Сумма всех этих напряжений представляет собой среднее напряжение на ванне.
Рабочее напряжение – это фактическое напряжение, определяемое показаниями вольтметра на ванне, т.е. это среднее напряжение без учёта падения напряжения в общесерийной ошиновке и среднего повышения от анодных эффектов:
Uр = Еэдс + η + ΔUэл + ΔUа + ΔUк + ΔUош + ΔUс + ΔUаэ.(12)
Греющее напряжение учитывает падение напряжения во всех греющих элементах электролизёра:
Uгр = E + η + ΔUэл + ΔUа + ΔUк + ΔUаэ.(13)
Составляющие напряжения, указанные в (1–3), формируют электрохимическую составляющую напряжения ванны, все остальные – омическую.
Заданное (уставочное) напряжение – напряжение, установленное на электролизере персоналом корпуса для осуществления задачи автоматического регулирования МПР (межполюсного расстояния).
На практике стабильный энергетический режим достигается, когда подобранное заданное напряжение соответствует рабочему напряжению электролизера. В условиях различных конструкций, сроков службы, состояния штырей и других индивидуальных особенностей электролизеров подбор заданного напряжения является одной из главных задач управления технологическим процессом в корпусе. Анализ работы электролизеров с приблизительно равным сроком службы и одинаковой конструкцией катода показал, что заданное напряжение между ваннами может отличаться на сотни милливольт! Это означает, что абсолютно одинаковые ванны могут работать с МПР, отличающимся на величину до 1.0 см, с расходом электроэнергии, отличающимся на 300 – 600 кВт∙ч/тAl и выходом по току - на несколько процентов. Потому в условиях развитой базы компьютерного моделирования, средств автоматизации и контроля электролиза алюминиевые заводы ставят задачи стандартизации управления энергетическим режимом электролизеров, через стандартизацию приемов подбора заданного напряжения.
Более подробно о каждом аспекте электролитического получения алюминия расписано в соответствующем разделе сайта.